♛ 办理条件 / Conditions
申请人应为境内依法进行登记的企业
۞ 申请材料清单 / List of application materials
1.申请表
2.证明性文件
(1)企业营业执照副本复印件。
(2)组织机构代码证复印件。
3.注册人关于变更情况的声明
4.原医疗器械注册证及其附件复印件、历次医疗器械注册变更文件复印件
5.变更申请项目申报资料要求
根据具体变更情况选择提交以下文件:
(1)产品名称变化的对比表及说明。
(2)产品技术要求变化的对比表及说明。
(3)型号、规格变化的对比表及说明。
(4)结构及组成变化的对比表及说明。
(5)产品适用范围变化的对比表及说明。
(6)进口医疗器械生产地址变化的对比表及说明。
(7)注册证中“其他内容”变化的对比表及说明。
(8)其他变化的说明。
6.与产品变化相关的安全风险管理报告
7.变化部分对产品安全性、有效性影响的资料分析并说明变化部分对产品安全性、有效性的影响,并提供相关的研究资料。适用范围变化的必须提供临床评价资料。
8.针对产品技术要求变化部分的注册检验报告
9.符合性声明
(1)注册人声明本产品符合《医疗器械注册管理办法》和相关法规的要求;声明本产品符合现行国家标准、行业标准,并提供符合标准的清单。
(2)所提交资料真实性的自我保证声明。
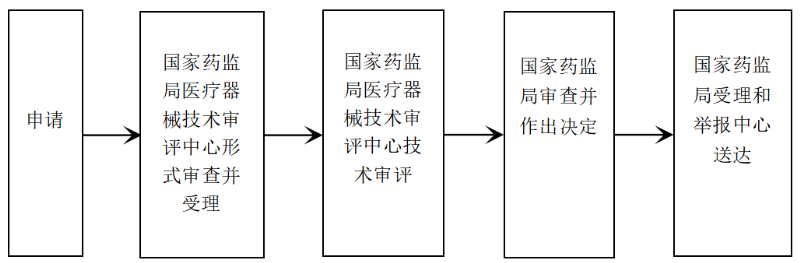
㉿ 办理流程 / Processing process
❈ 广东政务局服务承诺时间 / Service Commitment Time of Guangdong Government Bureau
|
名称
|
解释说明
|
时限
|
|
受理
|
|
5(工作日)
|
|
行政许可决定
|
20个工作日(不含技术审评和申请人补充资料及补充资料审评所需的时间)。20个工作日内不能做出决定的,经局领导批准,可延长10个工作日。
|






