♛ 办理条件 / Conditions
1、申报注册的产品已经列入《总局关于发布医疗器械分类目录的公告》(2017年第104号)的附件《医疗器械分类目录》,且管理类别为第二类。(注:对新研制的尚未列入分类目录的医疗器械,申请人可以直接向国家食品药品监督管理总局申请第三类医疗器械产品注册,也可以依据分类规则判断产品类别并向国家食品药品监督管理总局申请类别确认后,申请产品注册或者办理产品备案。)
2、申请人应当是在广东省辖区范围依法进行登记的企业(医疗器械注册人制度试点申请人要求另行规定)。
3、申请人建立与产品研制、生产有关的质量管理体系,并保持有效运行。申请注册时样品不得委托其他企业生产,按照创新医疗器械特别审批程序审批的或符合医疗器械注册人制度试点要求的产品除外。
4、办理医疗器械注册事务的人员应当具有相应的专业知识,熟悉医疗器械注册或者备案管理的法律、法规、规章和技术要求,如:《医疗器械监督管理条例》、《医疗器械注册管理办法》、《医疗器械分类规则》、《关于进一步做好医疗器械产品分类界定工作的通知》、《关于发布医疗器械产品技术要求编写指导原则的通告》、《医疗器械临床试验规定》、《医疗器械临床评价技术指导原则》、《医疗器械说明书和标签管理规定》、食品药品监管总局关于实施《医疗器械注册管理办法》和《体外诊断试剂注册管理办法》有关事项的通知、《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》等。
5、申请人申请注册,应当遵循医疗器械安全有效基本要求,保证研制过程规范,所有数据真实、完整和可溯源。
6、申请注册的资料应当使用中文。根据外文资料翻译的,应当同时提供原文。引用未公开发表的文献资料时,应当提供资料所有者许可使用的证明文件。申请人对资料的真实性负责。
7、纳入广东省医疗器械注册人制度试点的注册申请人还应同时符合以下条件:
(1)住所位于广州、深圳、珠海市辖区范围内,可以是企业、研发机构和科研人员
(2)委托在广东省行政区域内依法设立的企业生产本产品;
(3)应当配备专职的法规事务、质量管理、上市后事务等相关人员,以上人员应具有相应的专业背景和工作经验,并不得相互兼职;
(4)具备医疗器械全生命周期管理能力,有对质量管理体系进行评估、审核和监督的人员和条件;
(5)具备承担医疗器械质量安全责任的能力,确保研制过程规范,所有数据真实、完整、可追溯。
注:纳税信用A级纳税人、安全生产领域守信生产经营单位及其有关人员、海关高级认证企业,在办理第二类医疗器械产品注册时,可参照《广东省药品监督管理局第二类医疗器械优先审批程序》办理。
۞ 申请材料清单 / List of application materials
|
1、医疗器械注册申请表
2、证明性文件
3、医疗器械安全有效基本要求清单
4、综述资料
5、研究资料
6、生产制造信息
|
7、临床评价资料
8、产品风险分析资料
9、产品技术要求
10、产品注册检验报告
11、产品说明书和最小销售单元的标签样稿
12、 符合性声明
|
✪ 办理依据 / Processing basis
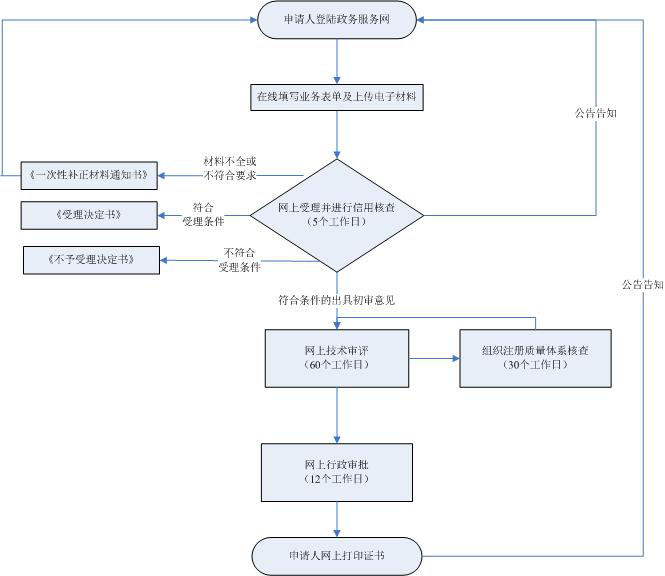
❈ 办理时间 / Processing time
|
名称
|
说明
|
时限
|
|
承诺办结时限
|
受理注册申请的药品监督管理部门应当在技术审评结束后12个工作日内作出决定...
|
12(工作日)
|
|
法定办结时限
|
受理注册申请的药品监督管理部门应当在技术审评结束后20个工作日内作出决定...
|
20(工作日)
|
|
到现场次数
|
|






